С согласия автора публикуем главу III из книги А. Н. Полякова «Краткий очерк истории медицинских масок«, посвященную проблеме эффективности использования масок, а также медицинским и социальным проблемам, связанным с их использованием.










С согласия автора публикуем главу III из книги А. Н. Полякова «Краткий очерк истории медицинских масок«, посвященную проблеме эффективности использования масок, а также медицинским и социальным проблемам, связанным с их использованием.











Противоэпидемическая маска возникла в контексте эпидемии маньчжурской чумы 1910 – 1911 годов как симукляр «научно обоснованной борьбы» с невидимыми силами экзистенциального риска, имитируя «последний барьер» между человеком и «вирусами-убийцами».





Поляков А. Н.
Краткий очерк истории медицинских масок
– Almaty: nobel group publishing house, 2021. – 57 с., илл.
УДК 614.442
ББК 5г
После начала вспышки респираторной инфекции, соотносимой с вирусом SARS-CoV-2, из-за отсутствия компетенций и понимания как механизмов распространения инфекционных заболеваний, так и знания технологий, которые могут эффективно предотвращать распространение патогенов, начали использоваться устройства, бессмысленность и неэффективность которых очевидна любому специалисту. Одним из таких устройств является дезинфекция с использованием так называемых «дезинфекционных туннелей». Следует отметить, что WHO и FDA сразу указали на то, что нет никаких научных данных подтверждающих то, что указанные устройства способны хоть каким-то образом влиять на снижение уровня заражений и на то, что использование этих устройств может быть опасным. Приведенные ниже материал содержит тезисы небольшой аналитической записки, подготовленной 5 апреля 2020 года по просьбе одного государственного ведомства санитарно-эпидемиологического надзора.
Эффективность химической дезинфекции определяется:
По просьбе одного из клиентов был проведен анализ соответствия антисептического средства условиям технического задания. Ниже приведена аналитическая часть экспертизы.
Спирты являются эффективными противомикробными средствами, наиболее широко используются этиловый спирт, изопропиловый спирт (изопропанол) и н-пропанол, который считается предпочтительным в EU [1]. Спирты обладают быстрым антимикробным действием широкого спектра против вегетативных бактерий (включая микобактерии), вирусов и грибов, не обладают спороцидным действием, но ингибируют споруляцию и прорастание спор [2]. Из-за отсутствия спороцидной активности спирты не рекомендуются для стерилизации, но широко используются как для дезинфекции твердых поверхностей, так и для антисептики кожи. Многие спиртовые дезинфектанты содержат незначительные количества других биоцидов, которые остаются на коже после испарения спирта, или вспомогательные вещества (включая смягчающие вещества), которые сокращают время испарения спирта и могут значительно повысить эффективность продукта [3]. Считается, что изопропиловый спирт несколько более эффективен против бактерий [4], а этиловый спирт более эффективен против вирусов [5]. Однако следует отметить, что такие эффекты зависят как от концентрации спирта, так и от тестового микроорганизма, например, изопропиловый спирт обладает более высокими липофильными свойствами, чем этиловый спирт, и менее активен против гидрофильных вирусов (например, полиовируса). Как правило, антимикробная активность спиртов значительно и нелинейно снижается в концентрациях ниже 50 %, поэтому оптимальным является содержание спиртов в составе продукта в диапазоне от 60 до 90 %.
Научного консенсуса о специфическом механизме действия спиртов нет, но, исходя из повышенной эффективности спиртов в присутствии воды, считается, что они вызывают повреждение клеточных мембран и быструю денатурацию белков с нарушением метаболизма и последующий лизис клеток [6], что подтверждается сообщениями исследователей о денатурации дегидрогеназы Escherichia coli [7] и увеличенной лаг-фазе Enterobacter aerogenes, предположительно из-за ингибирования метаболизма, необходимого для быстрого деления клеток [8].
Из научной литературы известно, что н-пропиловый спирт более эффективен, чем изопропиловый спирт (nPA — 3.12 % против iPA — 6.25 %), для уничтожения метициллинрезистентного золотистого стафилококка (MSSA) [9].
Соединения четвертичного аммония (ЧАС), являются наиболее эффективными дезинфицирующими активно-действующими веществами из группы КПАВ [10]. ЧАС используют для множества клинических целей (например, для предоперационной дезинфекции неповрежденной кожи, нанесения на слизистые оболочки и дезинфекции некритических поверхностей). Помимо антимикробных свойств, ЧАС также отлично подходят для очистки и дезодорации твердых поверхностей.
Известно, что ЧАС являются мембранно-активными агентами [11], преимущественно повреждающими цитоплазматическую мембрану бактерий или плазматическую мембрану грибов. Сэлтон [12] предложил следующую последовательность событий с микроорганизмами, подвергнутыми воздействию катионных агентов: (i) адсорбция и проникновение агента в клеточную стенку; (ii) реакция с цитоплазматической мембраной (липидом или белком) с последующей дезорганизацией мембраны; (iii) утечка внутриклеточного низкомолекулярного материала; (iv) деградация белков и нуклеиновых кислот; и (v) лизис стенок, вызванный автолитическими ферментами. Таким образом, у бактерий происходит потеря структурной организации и целостности цитоплазматической мембраны, а также другие повреждающие эффекты для бактериальной клетки [13]. ЧАС споростатичны; они подавляют рост спор (развитие вегетативной клетки из проросшей споры), но не сами процессы прорастания (развитие от покоя до метаболически активного состояния), хотя и по неизвестному механизму [14]. Аналогичным образом, ЧАС не являются микобактерицидными, но обладают микобактериостатическим действием, хотя фактическое воздействие на микобактерии мало изучено [15].
Хотя в некоторых исследованиях отмечено повышение толерантности к ЧАС, доказательств, подтверждающих развитие устойчивости к ЧАС в настоящее время нет [16]. Использование ЧАС конкретного наименования имеет свои преимущества и недостатки для конкретной ситуации, то есть выбор того или иного ЧАС в составе средства определяется для конкретного патогена, и этот фактор имеет решающее значение.
Полигексаметиленгуанидина гидрохлорид (CAS# 57028-96-3) является дериватом гуанидина, свойства, эффективность и воздействие которого еще не полностью изучены. В соответствии с Директивой по биоцидным продуктам от 16 февраля 1998 года (Directive 98/8/EC), вещество входящее в этот класс веществ (PHMB), на основании трех исследований, проведенных во время обзора досье BPR, было классифицировано как канцероген Carc. cat. 2 + H351 (подозревается как причина рака), категория 3; R40 (ограниченное доказательство канцерогенности). С данным веществом связано ряд инцидентов, в том числе с летальным исходом в Республике Корея в 2006 – 2011 годах (запрещено к применению в Республике Корея в 2011 году) [17] [18]. В мае 2016 года компания Reckitt Benckiser признала, что её продукты, содержащие ПГМГ, вредны [19]. ПГМГ ранее использовался в виде водного раствора (200 — 5000) ppm для дезинфекции кожи и инструментов. С 1 февраля 2013 года Европейская комиссия запретила использование ПГМГ в странах Европейского Союза во всех его ранее разрешенных областях применения. Европейская комиссия запретила размещение на рынке и использование ПГМГ для всех биоцидных целей [20].
Исходя из химического профиля данного соединения можно утверждать, что ПГМГ не является веществом, улучающим состояние кожи, использование его для таких целей неизвестно. Европейское химическое агентство (ECHA) своем сайте сообщает: «causes skin irritation, may cause an allergic skin reaction and may cause respiratory irritatio» (вызывает раздражение кожи, может вызывать аллергическую кожная реакция и может вызвать раздражение дыхательных путей) и «A majority of data submitters agree this substance is Skin sensitizing» (Большинство заявителей на регистрацию согласны с тем, что это вещество вызывает сенсибилизацию кожи) [21].
TETRANYL® U – продукт компании Kao Corporation, химическое наименование по INCI: метосульфат ундециленамидопропилтримония, CAS# 94313-91-4. Производителем [компанией КАО] этот продукт определяется как «Hair conditioning agent. It provides smoothness, shine and anti-static properties to the hair, making easy to comb it» (Агент для кондиционирования волос. Придает волосам гладкость, блеск и антистатические свойства, что облегчает их расчесывание) [22]. Данное соединение охарактеризовано AOEC (Ассоциация профессиональных и экологических клиник) как «A similar compound is a known human toxicant or allergen» (Подобное соединение является известным токсическим веществом или аллергеном для человека) [23]. В рецензируемой публикации сообщается, что соединение может вызывать репродуктивную токсичность у животных [24].
Глицерин, простейший представитель трёхатомных спиртов с формулой C3H5(OH)3, CAS# 56-81-5. Не токсичен, Европейское химическое агентство (ECHA) своем сайте сообщает: «According to the notifications provided by companies toECHA in REACH registrations no hazards have been classified» (Согласно уведомлениям, предоставленным компаниями в ECHA при регистрации REACH, опасности не были классифицированы) и «ECHA has no data from registration dossiers on theprecautionary measures for using this substance» (У ECHA нет данных из регистрационных досье о мерах предосторожности при использовании этого вещества) [25].
Глицерин обладает умеренным противомикробным и противовирусным действием и одобрен FDA [26] для лечения ран. Красный Крест сообщает, что 85 % раствор глицерина проявляет бактерицидные и противовирусные эффекты, а в ранах, обработанных глицерином, наблюдается уменьшение воспаления примерно через 2 часа. Благодаря этому он широко используется в продуктах для ухода за ранами, включая гидрогелевые листы для ожогов и другие средства ухода за ранами. Он одобрен для всех видов ухода за ранами, кроме ожогов третьей степени, и используется для упаковки донорской кожи, используемой в кожных трансплантатах [27]. Глицерин используется в медицинских, фармацевтических препаратах и средствах личной гигиены как увлажняющий кожу агент. Глицерин замедляет или предотвращает чрезмерное испарение спирта и воды с кожи, влияя на соотношение воды и спирта, которое, в свою очередь, влияет на антимикробную эффективность используемого средства.
Глицерин является наиболее эффективным увлажнителем по сравнению со многими другими веществами, в том числе a-гидроксикислотами, такими как молочная кислота и гликолевая кислота, гиалуроновая кислота, пропиленгликоль и бутиленгликоль, сорбитол, карбамид [28].
[1] Morton H. E. Alcohols. In: Bloch S. S., editor. Disinfection, sterilization, and preservation. 3rd ed. Philadelphia, Pa: Lea & Febiger; 1983. pp. 225–239
[2] Yasuda-Yasuki Y., Namiki-Kanie S., Hachisaka Y. Inhibition of germination of Bacillus subtilis spores by alcohols. In: Chambliss G., Vary J. C., editors. Spores VII. Washington, D.C: American Society for Microbiology; 1978. pp. 113–116.
[3] Bush L. E., Benson L. M., White J. H. Pig skin as a test substrate for evaluating topical antimicrobial activity. J. Clin. Microbiol. 1986;24:343–348.
[4] Coulthard C. E., Skyes G. Germicidal effect of alcohol. Pharm. J. 1936;137:79–81.
[5] Klein M., Deforest A. Principles of viral inactivation. In: Block S. S., editor. Disinfection, sterilization and preservation. 3rd ed. Philadelphia, Pa: Lea & Febiger; 1983. pp. 422–434.
[6] Larson E. L., Morton H. E. Alcohols. In: Block S. S., editor. Disinfection, sterilization, and preservation. 4th ed. Philadelphia, Pa: Lea & Febiger; 1991. pp. 191–203.
[7] Sykes G. The influence of germicides on the dehydrogenases of Bact. coli. 1. The succinic acid dehydrogenase of Bact. coli. J Hyg. 1939;39:463–469.
[8] Dagely S., Dawes E. A., Morrison G. A. Inhibition of growth of Aerobacter aerogenes: the mode of action of phenols, alcohols, acetone and ethyl acetate. J. Bacteriol. 1950;60:369–378.
[9] Man A., A. Ş. Gâz, Mare A. D., Berţa L. Effects of low-molecular weight alcohols on bacterial viability. Revista Română de Medicină de Laborator Vol. 25, Nr. 4, Octombrie, 2017
[10] Frier M. Derivatives of 4-amino-quinaldinium and 8-hydroxyquinoline. In: Hugo W B, editor. Inhibition and destruction of the microbial cell. London, England: Academic Press, Ltd.; 1971. pp. 107–120.
[11] Hugo W. B., Frier M. Mode of action of the antibacterial compound dequalinium acetate. Appl Microbiol. 1969;17:118–127.
[12] Salton M. R. J. Lytic agents, cell permeability and monolayer penetrability. J. Gen. Physiol. 1968;52:277S–252S
[13] Denyer S. P. Mechanisms of action of antibacterial biocides. Int Biodeterior Biodegrad. 1995;36:227–245.
[14] Russell A. D. Bacterial spores and chemical sporicidal agents. Clin. Microbiol. Rev. 1990;3:99–119.
[15] Russell A. D. Activity of biocides against mycobacteria. J. Appl. Bacteriol., Symp. Suppl. 1996;81:87S–101S.
[16] Gerba C. P. Quaternary Ammonium Biocides: Efficacy in Application. American Society for Microbiology Journals. 2015. Volume 81. Number 2. pp. 464 — 469
[17] Cummings K.J., Kreiss K. Occupational and environmental bronchiolar disorders. Semin. Respir. Crit. Care Med. 2015 Jun;36(3):366-78. Epub 2015 May 29.
[18] Dirk W. Lachenmeier. Chapter 24 – Antiseptic Drugs and Disinfectants // Side Effects of Drugs Annual. — 2015. — Т. 37. — С. 273—279.
[19] https://www.bbc.com/news/world-asia-36185549
[20].http://www.tukes.fi/fi/Ajankohtaista/Tiedotteet/Kemikaalituotevalvonta/Rajoituksia-ja-kieltoja-eraille-desinfioiville-aineille/
[21] https://echa.europa.eu/substance-information/-/substanceinfo/100.218.333
[22] https://www.ulprospector.com/en/la/PersonalCare/Detail/33232/996226/TETRANYL-U
[23] AOEC (Association of Occupational and Environmental Clinics) 2012. Asthmagen compilation — AEOC exposures codes.
[24] Melin V. E., Potineni H., Hunt Patricia, Griswold J., Siems B., Werre S. R. & Hrubec T. C. Exposure to common quaternary ammonium disinfectants decreases fertility in mice. 2014. Reproductive toxicology (Elmsford, N.Y.) 50, 163-170
[25] https://echa.europa.eu/substance-information/-/substanceinfo/100.000.263
[26] https://www.accessdata.fda.gov/scripts/cdrh/cfdocs/cfcfr/CFRSearch.cfm?fr=182.1320&SearchTerm=glycerin
[27] Stout Ed. I., McKessor A. Glycerin-Based Hydrogel for Infection Control. Adv Wound Care (New Rochelle). 2012 Feb; 1(1): 48–51.
[28] Sethi A., Kaur T., Malhotra S.K., Gambhir M.L. Moisturizers: The Slippery Road. Indian J. Dermatol. 2016 May-Jun; 61(3): 279–287.

В журнале «Управление финансовыми рисками» опубликована статья А. Полякова «Коммерческий кредит и его особенности применительно к бизнес-практике«. В статье рассматриваются характеристики коммерческого кредита как особой формы краткосрочного финансирования и специфика отношений поставщика и покупателя при использовании такой практики. Предлагается подход к оценке и снижению кредитного риска для поставщика.
Поляков А. Н. Коммерческий кредит и его особенности применительно к бизнес-практике // Управление финансовыми рисками. — 2020. — No4. — С.292–299.
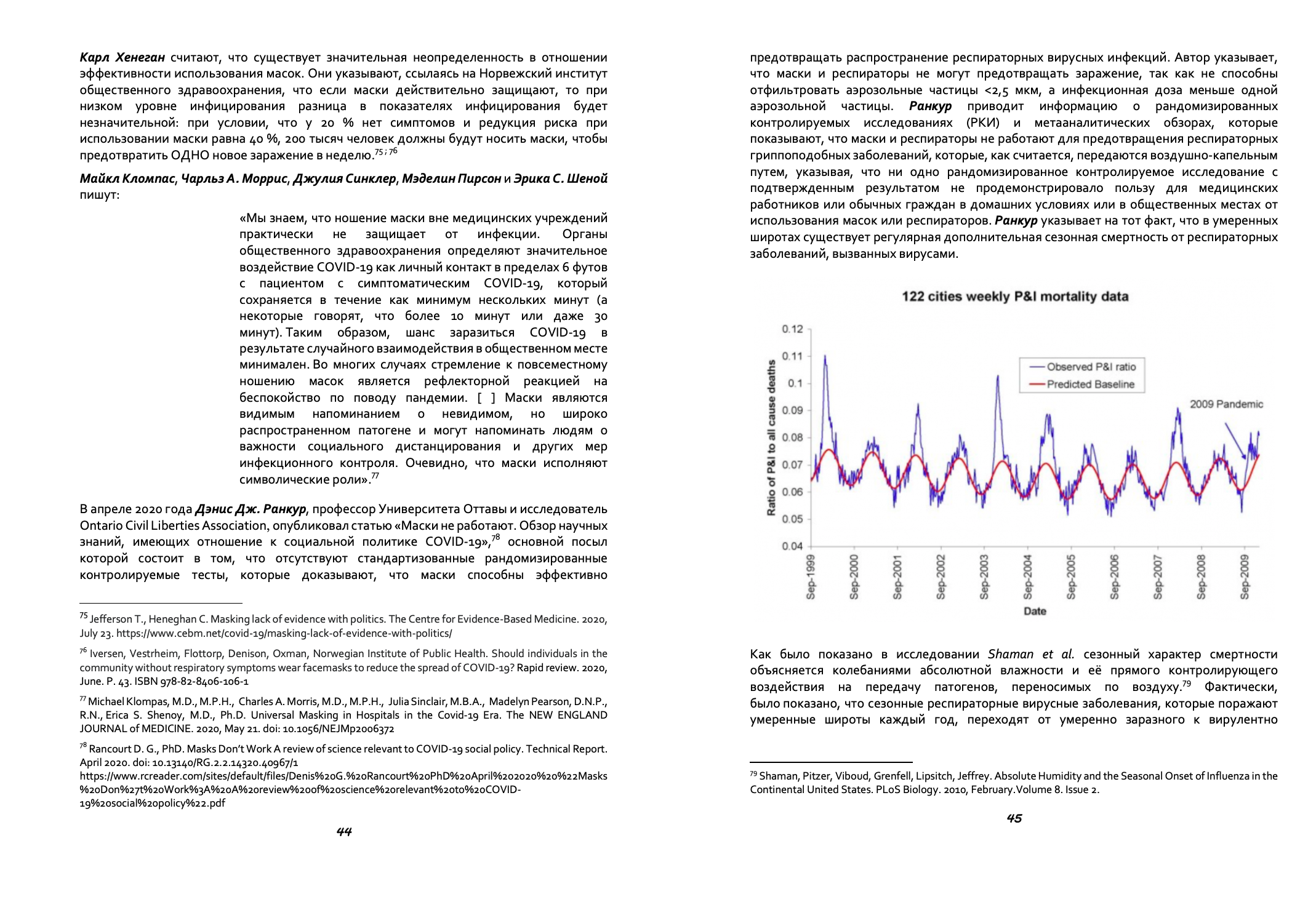
Эксперимент 1: В этом исследовании увеличение концентрации рабочего раствора нехлорных моющих средств при использовании с холодной водой компенсировало низкую температуру раствора и исключение хлора (таблица 2). Однако программы «холодной» очистки, как правило, имели более широкий разброс результатов для TBC и LPC и не показали сравнимую эффективность на пластиковых поверхностях по отношению к программам, использующим ежедневную горячую очистку. Считается, что эффективность очистки моющих средств возрастает с повышением температуры воды, а более низкая температура моющих растворов может повышать вариабельностью TBC в молоке.
Величина LPC в нефасованном молоке <200 КОЕ/мл считается приемлемой, а показатель LPC равен 10 КОЕ/мл говорит об очень хорошей гигиене оборудования. Все программы очистки, оцененные в этом исследовании, показали средние показатели LPC молока в допустимых пределах при оценке проб как с молокопроводов, так и из ёмкости сбора молока.
Была обнаружена значительная корреляция между местоположением доильного зала и показателем TBC. На всех трех доильных аппаратах было установлено одинаковое доильное оборудование и вспомогательное оборудование. Единственное различие между фермами заключалось в том, что на ферме А было наименьшее количество доильных аппаратов (n = 14) по сравнению с фермой B (n = 20) и фермой C (n = 30). Кроме того, различалась жесткость используемой воды: фермой A имела самый низкий уровень жесткости (56 ppm), за которой следовала ферма B (280 ppm), и затем ферма C, имеющая самый высокий уровень жесткости (468 ppm). Установлено, что жесткость воды влияет на качество очистки оборудования.
Более низкие значения показателей TBC и LPC, наблюдаемые в первой половине дня, по сравнению с вечерней дойкой, могут быть связаны с интервалом доения (17/7 ч), установленным на исследовательских фермах, и последующим влиянием этого интервала на эффективность некоторых моющих средств. Интервал между основным циклом очистки и ополаскиванием в такой ситуации был различным и данный фактор мог оказать влияние на полученные результаты.
Значительное увеличение показателя TBC наблюдалось на пластиковых поверхностях при использовании некоторых процедур очистки. Тем не менее использование горячей воды, присутствие гипохлорита натрия и ежедневная кислотная очистка – процедуры, каждая из которых индивидуально поддерживали низкий уровень TBC на таких поверхностях. Это доказывает тот факт, что ежедневное использование горячей воды или кислотной очистки может обеспечить необходимый уровень гигиены при использовании процедур очистки безхлорными моющими средствами больших доильных залов или на тех фермах, где высокий уровень жесткости воды.
Перекись водорода считается эффективной в окислении клеточного белка и поэтому может рассматриваться как альтернатива гипохлориту натрия в моющих растворах. Может потребоваться регулярное ежедневное использование перекиси водорода, чтобы наблюдать снижение показателя TBC по сравнении с использованием один раз в неделю при применении программ очистки T6 и T7.
Уровни трихлорметана (ТХМ) в пробах молока были удовлетворительными для всех программ очистки с максимумом при использовании гипохлорита натрия. Это указывает на то, что рабочие растворы чистящих средств содержащие 200 ppm гипохлорита натрия (T5), должны использоваться с надлежащей промывкой необходимым количеством воды для ополаскивания. В данном исследовании использовалось количество воды большее, чем то, которое считается достаточным для минимизации остатков моющих средств и обычно используется на фермах.
Результаты исследования показывают, что для очистки доильного оборудования можно рекомендовать использование не содержащих активный хлор моющих средств, в сочетании с ежедневным использованием горячей воды (T4) или кислотной очистки (T3) без каких-либо проблем с качеством как процедуры очистки, так и продукции.
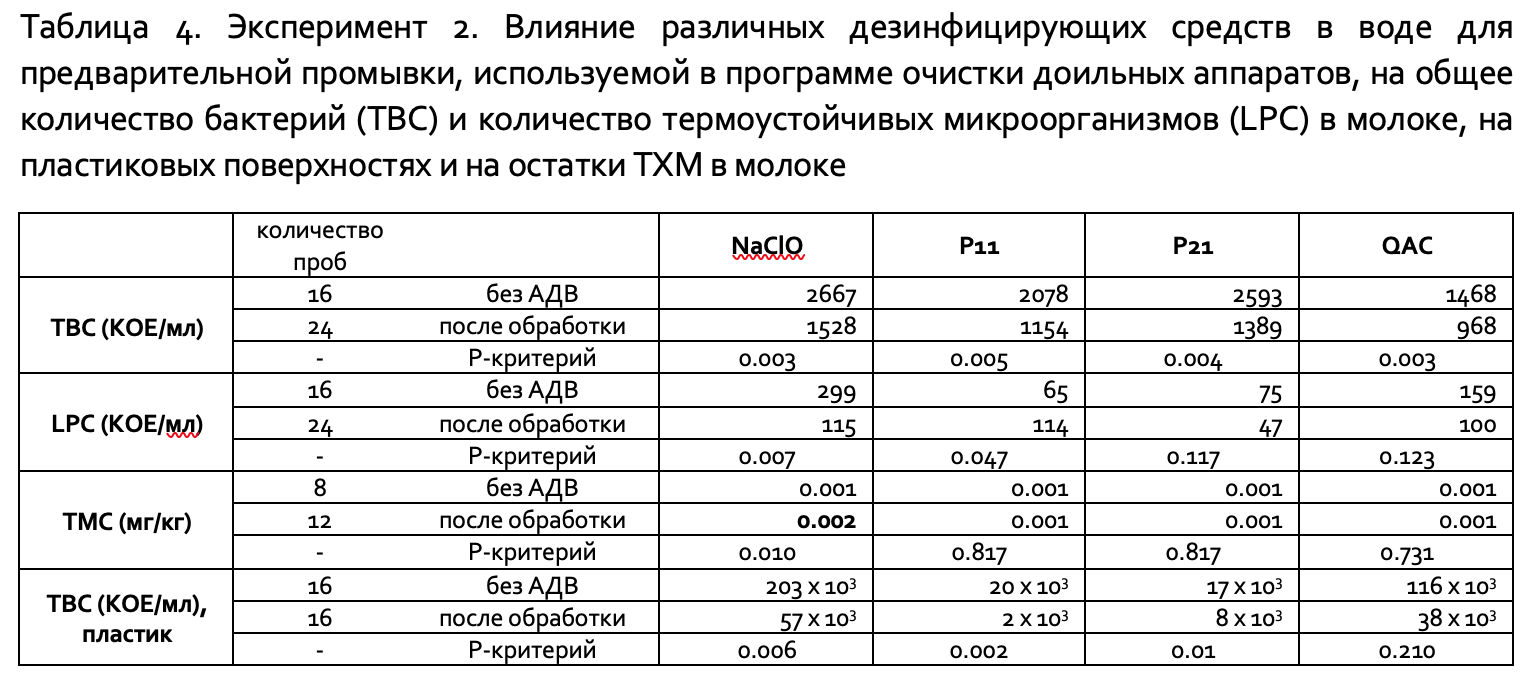
Эксперимент 2. Общее количество бактерий в молоке было ниже при добавлении дезинфицирующего средства в воду для предварительной промывки при автоматизированной мойке. Уровни LPC были особенно низкими до использования PA11 и PA21 (в среднем около 70 КОЕ/мл). Это может объяснить, почему при обработках не наблюдалось значительного снижения LPC, и может указывать на то, что применение дезинфицирующего средства имеет меньшую эффективность в ситуациях, когда оборудование очищено качественно. Дезинфекция и использованием QAC показало пролонгированный эффект (P>0,05). Однако растворы QAC вспенивались во время циркуляции. Можно сделать вывод, что соединения QAC следует использовать на фермах для дезинфекции методом «холодного тумана», использование их в системах CIP представляет сложность из-за пенообразования указанных АДВ. Однако следует отметить, что тестирование проб молока, после обработки с использованием QAC, на наличие остатков TХM показало очень низкие уровни.
Использование гипохлорита натрия приводило к значительному повышению уровня TХM в молоке после применения дезинфицирующего средства при предварительном ополоскании, и аналогичный тест также продемонстрировал повышение уровня TХM при последующем доении при применении NaClO.
Высокие бактериальные числа наблюдались на пластиковых поверхностях. Это может быть может объяснено старением и растрескиванием пластиковых деталей, так как на момент эксперимента они не заменялись несколько лет.
Различия уровней TBC и LPC в молоке наблюдались между некоторыми процедурами очистки. Процедуры, которые включали использование ежедневной очистки холодными растворами каустической содой в сочетании с ежедневной очисткой горячими растворами кислотных моющих средств, или горячим раствором моющего щелочного средства и дезинфицирующим средством два раза в день, показывали наименьший уровень TBC в молоке и на пластиковых поверхностях. Все дезинфицирующие средства, применяемые к промывочной воде перед доением, привели к значительному снижению TBC молока при последующем доении. Наименьшее количество бактерий на пластиковых поверхностях наблюдалось при использовании надуксусной кислоты. Надуксусная кислота может быть использована в качестве альтернативы гипохлориту натрия, использование которого приводит к более высоким уровням контаминации молока TХM.
Каждое дезинфицирующее средство применялось в течение 1 недели дважды за период испытаний. В течение каждой недели испытаний первый и второй дни недели использовались в качестве дней контрольных измерения (дезинфицирующий агент не применялся), а в дни 3, 4 и 5 применялась дезинфицирующая обработка.
Эксперимент 1. Семь программ очистки доильных аппаратов с использованием горячих или холодных растворов, содержащих различные уровни гидроксида натрия, с добавлением гипохлорита натрия или перекиси водорода в некоторых программах испытаний (таблица 1), сравнивались по эффективности поддержания низких уровней TBC и LPC в молоке.
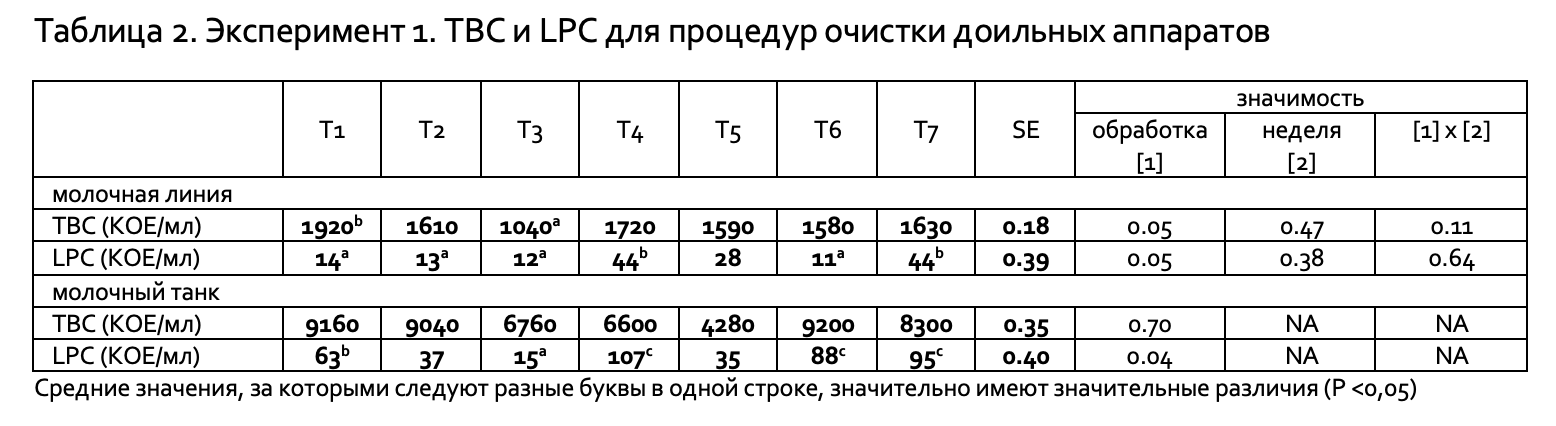
Программа очистки 3 (P3-mipCIP, использован холодным раствор и горячий (70 °C) раствор) с кислотной промывкой, заменяющей моющее средство во второй половине дня, показала значительно более низкие уровни TBC (1040 КОЕ/мл), чем T1 (продукт P3-mipCIP, использован холодным) (1920 КОЕ/мл) (P<0,05) и T4 (Hypral SP использован горячий (70 °C) раствор)(1720 КОЕ/мл) (P<0,07), и более низкие уровни, чем полученные при использовании других программ очистки (Таблица 2). Выявлены значительные различия значений LPC между программами очистки T1 (14 КОЕ/мл), T3 (12 КОЕ/мл) и T6 (Multisan CF, использован холодный раствор)(11 КОЕ/мл) по сравнению с T4 (44 КОЕ/мл ) и T7 (Parlorsan NC, использован холодный раствор) (44 КОЕ/мл) (P<0,05). Контрольная программа очистки (T5) (Liquid Gold, используется горячий (70 °C) раствор), содержавшая смесь гидроксида натрия и гипохлорит натрия, показала незначительные отличия TBC и LPC от всех других программ очистки. Однако диапазон полученных значений LPC был больше при некоторых программах «холодной» очистки [T1 (0–2700 КОЕ/мл); T6 (0–2600 КОЕ/мл)] по сравнению с программами очистки с использованием горячих растворов [T2 (P3-mipCIP, используется горячие растворы) (0–790 КОЕ/мл); T3 (0–360 КОЕ/мл); T5 (0–610 КОЕ/мл)]. Самые низкие значения TBC были при ежедневной горячей очистке для T3 (3500 КОЕ/мл) и T5 (4300 КОЕ/мл) в сравнении с T1 (6700 КОЕ/мл); T6 (6300 КОЕ/мл) и T7 (9400 КОЕ/мл). Не было никаких существенных различий TBC между программами очистки (P>0,05) для проб из молочного танка. Однако контрольная программа очистки (T5) имела численно самый низкое значение TBC (4280 КОЕ/мл), за которым следовали программы T4 (6600 КОЕ / мл) и T3 (6760 КОЕ / мл), а системы холодной очистки имели самые высокие показатели TBC из проб, взятых в молочном танке: Т1 (9160 КОЕ/мл) и Т6 (9200 КОЕ/мл). Программа очистки, включавшая ежедневную кислотную очистку (T3), имела значительно более низкий показатель LPC по сравнению с Т1, Т4, Т6 и Т7 (Р<0,05). Время обора проб молока показало значительную корреляцию как на показатель TBC, так и на показатель LPC: пробы, взятые при утренней дойке имели более низкий TBC (1450 КОЕ / мл), чем пробы, взятые при вечернем доении (1680 КОЕ/мл) (P<0,01). Точно так же время отбора проб оказывало влияние на значения LPC: 39 КОЕ/мл вечером в сравнении с 14 КОЕ/мл утром (P<0,001).
Наблюдалась значительная корреляция (P <0,05) между местоположением доильного помещения и TBC, при этом ферма A имела более низкий TBC (1170 КОЕ / мл), чем ферма B (1660 КОЕ / мл) или C (1950 КОЕ / мл).
Значительное увеличение значения TBC наблюдалось на пластиковых поверхностях между 1 и 3 неделями при использовании программ очистки T1, T2, T6 и T7 (P<0,05), но различия для программ очистки T3, T4 и T5 были не существенными (таблица 3). Общее количество бактерий не увеличилось значительно на прокладках (диапазон от 100 до 140 КОЕ/мл) и на поверхностях из нержавеющей стали (диапазоне от 100 до 260 КОЕ/мл).

Эксперимент 2: Определялись средние значения TBC и LPC молока после обработки воды, применяемой для предварительного ополаскивания, дезинфицирующими агентами, указанными в Таблице 4. Существенные различия значений TBC и LPC проб молока, отобранных вначале и после трёх доек, не обнаружены.
Наиболее низкие значения TBC наблюдались в образцах молока с молочной линии после применения всех четырех дезинфицирующих агентов использованных в воде для предварительного промывания (P<0,01). Количественное снижение TBC между обработками не было значительным (P>0,05). Обработка PA11 (надуксусная кислота из расчета 0,688 мл/л) привела к увеличению уровня LPC, при использовании PA21 (надуксусная кислота из расчета 1,313 мл/л) и QAC наблюдалось снижение уровня LPC после санации.
Гипохлорит натрия имел значительно более высокие уровни TХM после санации (P<0,01). Высокая бактериальная обсемененность (в среднем 174 х 103 КОЕ/мл) наблюдались на пластиковых поверхностях до применения всех дезинфицирующих средств. Включение PA11, PA21 или гипохлорита натрия в качестве дезинфицирующего средства в промывную воду значительно снижало показатель TBC на этих пластиковых поверхностях (P<0,01) (Таблица 4).
(окончание следует)
Использование окислителей в процессах CIP-очистки приводит к появлению разнообразных побочных продуктов, влияние которых связывают с многочисленными последствиями для здоровья. Токсикология хлоратов и других хлорных побочных продуктов является областью возрастающего интереса из-за широкого распространения этих микроконтаминантов в пищевых продуктах.
Главные оксихлорные контаминанты и связанные с ними биологические риски с установленными рекомендациями, основанными на санитарно-гигиенических нормативах (TDI, ADI и ARfD) и нормативное значение MRL, приведены в таблице 1 (данные European Food Safety Authority).
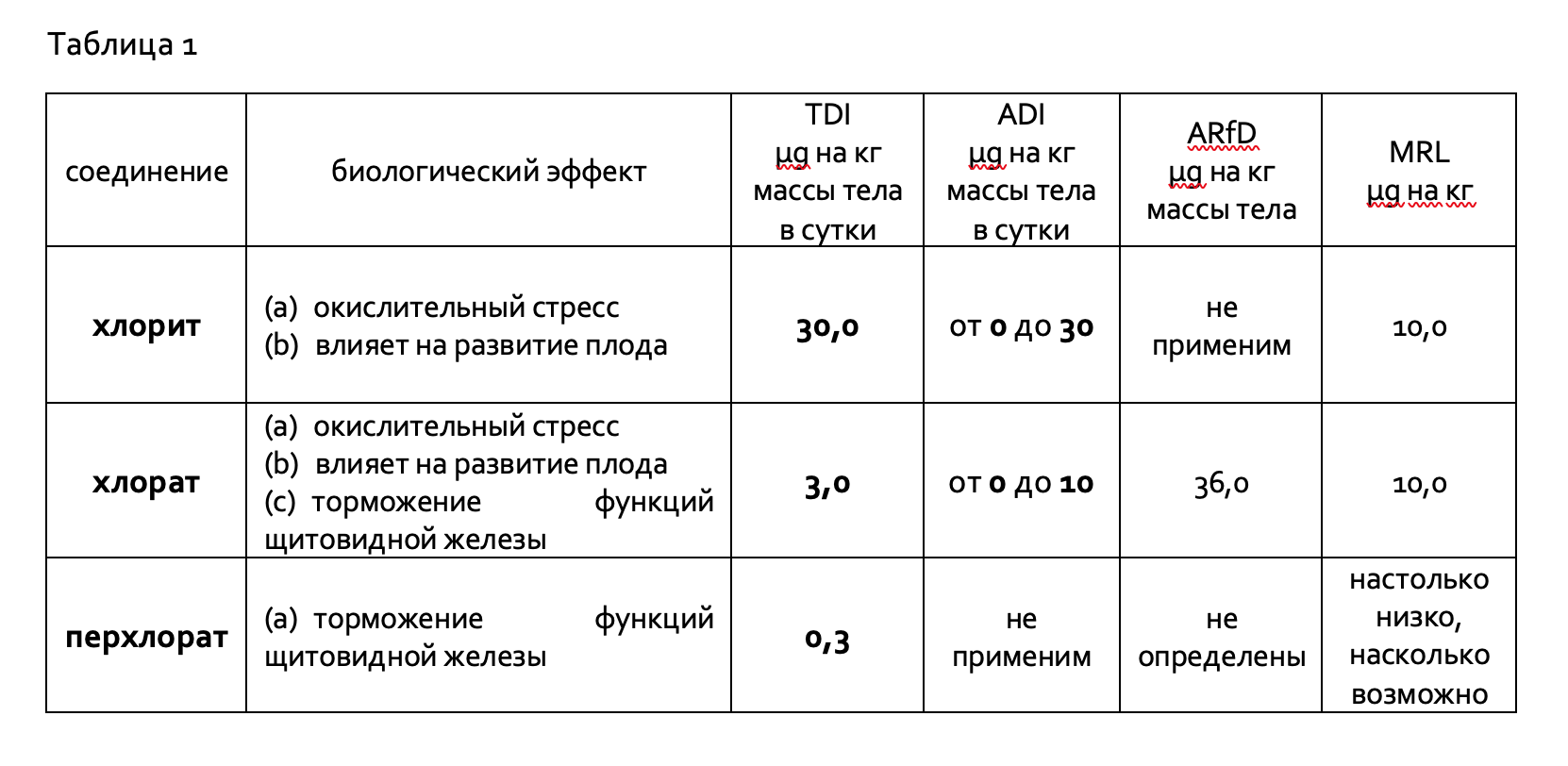
TDI — tolerable daily intake (допустимое ежедневное потребление)
ADI — acceptable daily intake (допустимая норма суточного потребления)
ARfD — acute reference dose (острая референтная доза)
MRL — maximum residue level (максимальный остаточный уровень)
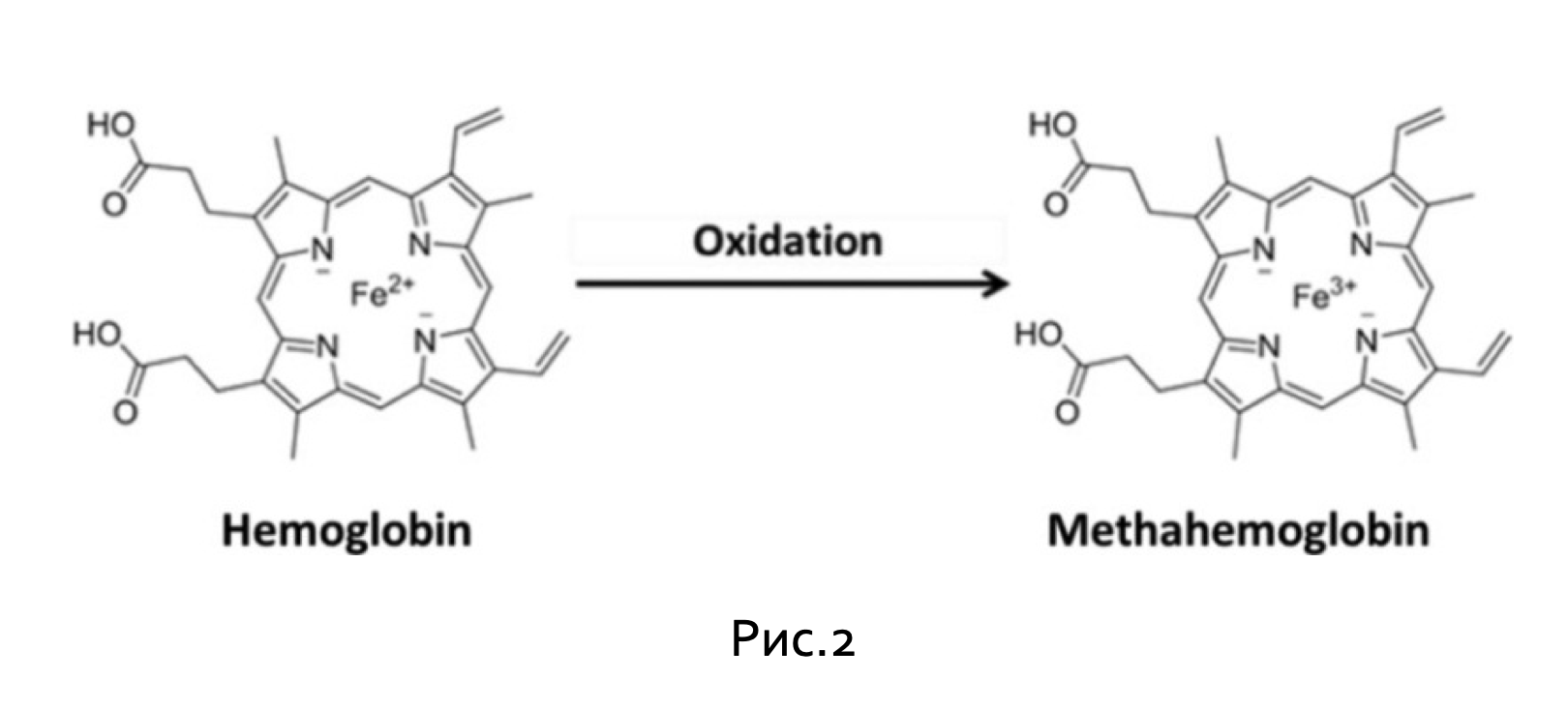
В кишечнике происходит взаимное превращение хлорита, хлората и хлорида, и было обнаружено, что оно вызывает окислительный стресс в организме. Организм имеет множество антиоксидантных механизмов для защиты своих клеток от этого процесса, в основным является глутатион (GSH) окислительно-восстановительный цикл. Однако, когда окислительный стресс слишком высок, защитный механизм не справляется, и в результате наносится существенный вред клеткам, который затрагивает протеины, липиды и аминокислоты. Кровь особенно чувствительна к окислительному стрессу, в результате его воздействия гемоглобин может быть окислен до метгемоглобина. Таким образом, клеточные мембраны могут подвергаться окислительному сшиванию белка цитоскелета клеток — спектрина и перекисному окислению липидов, приводящему к внутрисосудистому гемолизу.
Метгемоглобин образуется, когда Fe-центр дезоксигемоглобина окисляется от двухвалентного (Fe2+) до трехвалентного (Fe3+) состояния, как показано на рисунке 2, снижая его способность действовать как транспортное средство для переноса кислорода посредством изменения его способности обратимо связываться с кислородом. Это изменение вызывает тканевую гипоксию и метаболический ацидоз. Кроме того, метгемоглобин инициирует механизм воспалительного каскада, стимулируя высвобождение хемокинов интерлейкин-6, интерлейкин-8 и гликопротеина Е-селектина, которые вызывают высвобождение цитокинов и молекул клеточной адгезии, усиливая тем самым воспалительный ответ. Это может привести к острому повреждению почек и почечной недостаточности в случаях хронического воздействия, точный механизм которого еще не был ясно определён.
Младенцы гораздо более чувствительны, чем взрослые, к этой внутриклеточной индукции метгемоглобина. Это связано с относительной разницей редуктазы метгемоглобина в эритроцитах у новорожденных, поскольку эритроциты плода гораздо более чувствительны к восстановителям и потому, что у плода повышенная потребность в кислороде. Большую долю гемоглобина у детей составляет этот фетальный гемоглобин, который более легко окисляется до метгемоглобина, чем взрослый гемоглобин. Кроме того, растущую обеспокоенность вызывает то, что на 95-м процентиле установленное допустимое ежедневное потребление (TDI) для хлората было превышено во всех обследованиях «младенцев» и «малышей» в исследовании 2014 года.
Исследованиями, проведенными в 2012 году в Италии, установлено, что наличие повышенных уровней хлорита и хлората (> 700 мкг / л) приводит к значительному увеличению факторов риска дефектов мочевыводящих путей, расщелины неба, расщелины позвоночника и дефектов брюшной стенки для плодов матерей, подвергшихся воздействию высоких уровней хлората и хлорита во время беременности.
Хлорат и его окисленная форма перхлорат (ClO4—) ингибируют белок NIS (sodium/iodide symporter), обнаруженный в щитовидной железе и других тканях, который необходим для синтеза гормонов щитовидной железы трийодтиронина (Т3), который регулирует рост и клеточный метаболизм, и тироксина (Т4), который превращается в трийодтиронин в периферической ткани. NIS играет ключевую роль в пути производства этих гормонов посредством транслокации йодида в фолликулярные клетки, которые образуют тиреоглобулин. Белок тиреоглобулин подвергается расщеплению с выделением T3 и T4, в процессе, который регулируется гипофизом.
Химическое действие хлората сходно с действием перхлората, который хорошо известен как токсикант щитовидной железы. Перхлорат является гораздо более сильным ингибитором функций щитовидной железы, чем хлорат, поскольку он обладает более высокой аффинностью поглощения NIS. Перхлорат конкурентно ингибирует поглощение йодида NIS из-за сходства ионного радиуса и заряда, при этом аналогичные результаты получены для ионов близкого размера, таких как тиоцианат.
Хотя подавление гормонов щитовидной железы не является проблемой для большинства взрослых так как у них есть определённый запас накопленных гормонов щитовидной железы, у младенцев таких запасов гормонов щитовидной железы нет. Это означает, что они полностью зависят от ежедневного поступления гормонов щитовидной железы, чтобы удовлетворить потребности своего организма. Любое ингибирование щитовидной железы приведет к снижению уровня Т4 в сыворотке, а острый дефицит приведет к измеримым неврологическим и когнитивным нарушениям. Присутствие хлорных побочных продуктов в продуктах питания, потребляемых группами с дефицитом йода в группе риска, также повышает риск вышеупомянутых последствий для здоровья как в моделях острого, так и хронического воздействия.
(окончание следует)
(продолжение)
Неорганические производные хлора, попадая с пищей в организм человека, приводят гематотоксическим и нефротоксическим эффектами и к угнетению функций щитовидной железы. Наличие таких негативных последствий побудили установить обязательные лимиты для хлоритов и хлоратов в пищевых продуктах. Особые опасения вызывает наличие таких контаминатов в детском питании из-за повышенной восприимчивости детей к указанным токсическим эффектам, при этом следует учитывать, что молочные продукты часто являются основном ингредиентом в большинстве смесей кормления. В целом, более 600 летучих и нелетучих побочных продуктов были выявлены исследователями, изучавшими процессы очистки и дезинфекции с использованием хлорсодержащих продуктов на пищевых производствах.
Анализ молока, как жидкого, так и сухого, и других молочных продуктов сложен из-за ряда технических проблем. Молочные продукты содержат ряд компонентов, таких как белки, жиры и сахара, которые могут мешать проведению корректного анализа. Большинство аналитических методов включают стадию осаждения белка, например, добавлением органического растворителя, смешивающегося с водой, и кислоты. Жиры могут быть удалены из молока центрифугированием или твердофазной экстракцией.
В результате дезинфекции с использованием хлорсодержащих продуктов в результате реакций окисления образуются неорганические соединения хлора. Хлор способен образовывать большое количество окисленных неорганических побочных продуктов в следствии способности подвергаться окислительно-восстановительным реакциям.
Хлориты образуются в результате реакции двух частей гипохлорита и являются лимитирующей стадией образования хлората. В проведенных исследованиях кинетики реакции разложения растворов гипохлорита обнаружено, что хлорат образуется в концентрированных растворах гипохлорита во время их изготовления и хранения в результате следующих реакций:
OCl— + OCl— ➔ ClO2— + Cl—
OCl— + ClO2 ➔ ClO3 + Cl—
Было обнаружено, что при увеличении концентрации гипохлорит-иона в два раза скорость разложения возрастает в четыре раза, что делает его реакцией второго порядка. Таким образом, рекомендуется разбавлять растворы гипохлорита в два раза, что снижает концентрацию ионов гипохлорита и приводит к снижению скорости разложения. Условия хранения концентрированных растворов гипохлорита представляют собой серьезную проблему, поскольку скорость разложения пропорциональна молярности раствора. Рекомендуется, чтобы гипохлорит натрия хранился в сильнощелочных условиях при значениях рН более 12, это предотвращает быстрое разложение и обеспечивает достаточные концентрации гипохлорит-ионов.
Гидроксид натрия добавляется во время производства средств на основе гипохлорита натрия для обеспечения щелочной среды в которой разложение гипохлорита минимизировано до его окисленных продуктов разложения. Большинство чистящих средств, выпускаемых в США и Европейском Союзе, предназначенных для использования в системах CIP, содержат смесь гидроксида натрия (от 15 % до 20 %) и гипохлорита натрия (от 3 % до 9 %) при pH приблизительно 13 ед. pH.
Хлорноватистая кислота, протонированная форма гипохлорита, которая определяет процесс дезинфекции, представляет собой слабую кислоту с pKa 7,5 при 25 °C. Следует понимать то, что лишь при рН ниже 7,5 хлорноватистая кислота является доминирующим активным веществом по сравнению с гипохлорит-ионом, который является доминирующей формой при рН выше 7,5. Скорость разложения активного хлора увеличивается по мере того как среда становится более щелочной, что обусловлено нарушением термодинамической стабильности ионов гипохлорита и, теоретически, может приводить к разложению имеющихся побочных продуктов хлорита и хлората. Эти оксигалогениды подвергаются дальнейшим реакциям с образованием более термодинамически стабильных оксигалогенидов и могут дополнительно реагировать с образованием перхлоратов, как показано ниже:
ClO— + ClO2— ➔ ClO3— + Cl—
ClO3— + ClO— ➔ ClO4— + Cl—
Перхлорат-ион обнаруживается в растворах гипохлорита натрия, и, подобно хлорат-иону, концентрация перхлората со временем увеличивается. Скорость образования перхлората является реакцией второго порядка, зависящей от концентрации гипохлорита и хлората.
OCl— + ClO3— ➔ ClO4— + Cl—
d[ClO4—]/dt ➔ kClO-4[OCl—][ClO3—]
Имеется иная схема разложения гипохлорита без образования оксихлоридов, когда происходит разложение гипохлорита до кислорода и хлорида. Такая схема реализуется в присутствии определенных ионов металлов, при температурах выше 30 °C, при кислотном pH и в результате воздействия ультрафиолетового излучения.
2ClO ➔ O2 + Cl—
(продолжение следует)
Использование хлорсодержащих моющих средств для очистки и дезинфекции технологического оборудования на молоко-товарных фермах и молочных заводах приводит к загрязнению молока и молочных продуктов хлоратами и другими оксихлорными контаминантами. Хлораты и другие виды оксихлорных соединений в продуктах, как установлено, влияют на усвоение йода организмом человека и образование метгемоглобина, при этом новорожденные и малолетние дети подвержены наиболее высокому риску, в группу риска попадают также беременные и кормящие матери, которым йода нужно почти в два раза больше, чем обычному взрослому человеку. Вице-председатель Российской ассоциации эндокринологов, директор института клинической эндокринологии ФГБУ «Эндокринологический научный центр» Минздрава России Галина Мельниченко обращает внимание на то, что «У плода до 16 недели нет своей щитовидной железы, зато буквально с первых дней жизни эмбриону необходим мамин гормон – тирoксин. В противном случае могут возникнуть проблемы с развитием зрения, слуха. Тяжелый йододефицит чреват умственной отсталостью малыша. Хотя даже легкая степень нехватки йода приводит к тому, что уровень IQ ребенка будет на 10 — 15 пунктов ниже, чем у сверстников из благополучных в плане йода регионов. Чаще всего речь идет об IQ ниже 100, рассеянности, дефиците внимания, заторможенности».
Хлорат (ClO3—) и другие производные соединения хлора в последние годы стали серьёзной проблемой для пищевой промышленности, и особенно для предприятий по производству напитков и молочной продукции. Некоторые соединения хлора обладают высокой антимикробной активностью и, поэтому, их традиционно используют на фермах и на пищевых производствах с целью дезинфекции. Традиционно соединения хлора, используемые как средства дезинфекции, широко использовались для обеспечения надлежащего санитарно-гигиенического состояния пищевых производств в последние 200 лет благодаря своей высокой эффективности и низкой цены; однако образование хлорированных контаминантов как результат их использовании вызывает обеспокоенность у органов, регулирующих условия производства пищевых продуктов в развитых странах.
Качественная очистка оборудования для переработки и хранения молока имеет большое значение для предотвращения инфекционных заболеваний связанных с риском микробной контаминации молока, и хлорсодержащие средства широко используются для предотвращения указанных рисков в молочной промышленности.
Хлораты чаще всего являются побочным продуктом процессов очистки или дезинфекции. Такие побочные продукты образуются уже на фермах. Следует обратить внимание на то, что использование воды на всех стадиях молочного производства также является точкой риска. Очистка воды с помощью газообразного хлора (Cl2), диоксида (ClO2) или гипохлорита (ClO—) является в настоящее время обычной практикой. Поэтому следует проанализировать каким образом химический состав воды влияет на риск перекрестной контаминации молочной продукции.
Активный хлор, то есть хлор в той форме, которая легко доступна для химической реакции с микроорганизмами, обычно используется в процессах дезинфекции в форме газообразного хлора или гипохлорита (ClO—). В этих формах хлор является сильным окислителем и быстро вступает в реакцию с большим количеством химических соединений. Чаще всего такие соединения, например, сероводород (H2S), марганец (II), железо (II), сульфит (SO32-), бромид (Br—), йодид (I—) и нитрит (NO2) являются восстановителями. Упомянутые соединения могут действовать как катализаторы, способствуя образованию и сохранению хлорсодержащих побочных продуктов в составе пищевого сырья или готовой продукции.
Дезинфицирующие средства на основе гипохлорита натрия (NaClO) эффективны против широкого спектра микроорганизмов, включая грамположительные и грамотрицательные бактерии, споры бактерий и вирусы. В отличии от хлора, продукты на основе гипохлорита натрия легче транспортировать и хранить в местах использования. Для растворов гипохлорита хлорат является первичным побочным продуктом разложения, а динамика увеличения его количества в растворе определяется как условиями хранения, прежде всего температурой и воздействием ультрафиолетового диапазона естественного освещения, а также длительностью хранения продукта до использования.
Установлено, что в продуктах на основе гипохлорита натрия концентрация хлорита обычно находится в диапазоне от 135 до 310 мкг/л, а концентрация хлората в диапазоне от 1,67 до 13,35 мг/л.
Гипохлорит натрия является причиной образования такого опасного побочного продукта дезинфекции как трихлорметан (ТХМ), также называемый хлороформом. Максимальный уровень ТXМ в питьевой воде составляет 0,1 мг/кг. В ЕС нет MRL, установленного для содержания ТХМ в пищевых продуктах. Германия, однако, установила ограничение для продуктов питания на уровне требований к питьевой воде. Кроме того, были рекомендованы целевые уровни <0,03 и <0,002 мг/кг в масле и молоке, соответственно.
Диоксид хлора представляет собой почти полностью мономерную систему свободных радикалов. Газообразный диоксид хлора в высоких концентрациях является потенциально взрывоопасным, Попытки разработки технологий его хранения под высоким давлением, отдельно или в смеси с другими газами, пока не увенчались успехом. Поэтому диоксид хлора, как и озон, в настоящее время производят в месте его использования.
Хотя диоксид хлора обычно используется для обработки воды, его также применяют и для дезинфекции технологического трубопроводов и оборудования. Диоксид хлора образует значительно меньше вредных побочных продуктов дезинфекции чем гипохлориты и хлор, его антимикробная активность проявляется в более широком диапазоне рН, поэтому он является хорошей альтернативой для использования в пищевой промышленности.
Диоксид хлора не подвергается интенсивному гидролизу в воде. Было обнаружено, что нейтральные или кислые разбавленные водные растворы диоксида хлора относительно стабильны при хранении в закрытых контейнерах в прохладном и защищенном от прямых солнечных лучей месте. Диоксид хлора имеет степень окисления +4, которая находится между степенью окисления хлорита (+3) и хлората (+5). Диоксид хлора может разлагаться до хлорита в отсутствие окисляемых веществ и среде оснований; растворяясь в воде, диокисид хлора медленно разлагается с образованием хлорита и хлората:
2ClO2 + H2O ➔ ClO2— + ClO3— + 2H+
Разложение диоксида хлора приводит к образованию неорганических соединений, в том числе хлорита, хлората и хлорид-ионов. От 50 % до 70 % образовавшихся побочных продуктов представляют собой хлориты.
Диоксид хлора может участвовать в широким спектре окислительно-восстановительных реакций, например, в окислении йодид-иона, сульфид-иона, железа (II) и марганца (II). Диоксид хлора является хорошим акцептором электронов и не подвергается реакциям замещения в присутствии структур C – H или N – H. Для диоксида хлора характерны окислительные процессы (в отличие от газообразного хлора, который может подвергаться реакциям окисления и электрофильного замещения), именно это свойство объясняет отсутствие образования хлорорганических соединений.
Промышленный синтез диоксида хлора обычно выполняется с использованием водного раствора хлорита натрия и гипохлорита:
2ClO2— + HClO + H+ ➔ 2ClO2— + Cl— + H2O
Однако, когда эту реакцию проводят в эквимолярной реакции между хлоритом и гипохлоритом, реакция дает хлорат-ион.
ClO2— + HClO + H+ ➔ ClO3— + Cl— + H+
Вышеуказанная реакция распространена в производственных средах, где используются повышенные концентрации хлора, сдвигающие равновесие реакции вправо, увеличивая потребление хлорита. Альтернативным путем промышленного производства диоксида хлора является использование соляной кислоты (HCl), что приводит к снижению образования хлората.
5NaClO + 4HCl ➔ 4ClO2 + 5NaCl + H2O
Реакция взаимодействия диоксида хлора и органических веществ природного происхождения (NOM — natural organic matter) также может привести к образованию хлорита.
ClO2 + NOM ➔ продукт реакции + ClO2—
(продолжение следует)