Dong-Mei She 1,2, Hai-Lin Yu 2, Qi-Liang Huang 2, Fen-Ming Li 2 and Chun-Jiu Li 1,*
1 College of Science, China Agricultural University, Beijing 100193, China;
E-Mail: cjiuli@cau.edu.com (C-J.L.)
2 Plant Protection Institute of the Chinese Academy of Agricultural Sciences, Beijing 100193, China;
E-Mails: yuhaili6258@163.com (H.-L.Y.); qlhuang@ippcaas.cn (Q.-L.H.)
* Author to whom correspondence should be addressed; E-Mail: dmshe@ippcaas.cn;
Tel.: +86 1062890876; Fax: +86 1062816909.
Received: 30 January 2010; in revised form: 24 February 2010 / Accepted: 8 March 2010 / Published: 16 March 2010
Аннотация: В центре внимания этой работы было определить наиболее дешевый растворитель из числа дизельного топлива, керосина, сульфолана или смеси сульфолана и циклогексанола для приготовления циануровой кислоты гетероциклизацией мочевины. Чтобы получить более высокий выход, эффект катализаторов (натриевых, аммонийных, кальциевых и циннковых солей) и температуры в пределах (160-220) °С на тримеризацию мочевины также были тщательно изучены. Мы создали оптимальные реакционные условия и в дальнейшем подтвердили расширением масштабов наших экспериментов.
Ключевые слова: циануровая кислота; мочевина; жидкая фаза; выход продукции
Введение
Циануровая кислота (2,4,6-трихлор-1,3,5-триазин или изоциануровая кислоты) является ключевым промежуточным соединением для синтеза различных органических соединений, включая эпоксидные смолы, хлорированные дериваты, синтетические моющие средства, антиоксиданты, красители, пестициды, противоопухолевые агенты и прочие продукты. Кроме того, сырье для многих новых продуктов, таких как трихлоризоциануровая кислота (TCCA), 1,3,5-три-2-пропенил-1,3,5-триазин-2,4,6-(1H,3H,5H)-трион (TAIC), триглицидилизоцианурат (TGIC) и трикарбоксиэтил изоцианурат (TCIC). Эти новые продукты хорошо известны и широко используются в химическом машиностроении, легкой промышленности, в электрических приборах, в машиностроении, при изготовлении пряжи и сельском хозяйстве [1-4].
Циануровая кислота представляет собой белое кристаллическое вещество, с температурой плавления (145-148) °С и температурой кипения 190 °С. Были зарегистрированы различные методы синтеза циануровой кислоты. Эти методы можно разделить на два типа. Один метод включает производство циануровой кислоты из мочевины в качестве исходного материала, а другой включает полимеризацию хлорциана или переработкой HCN и Cl в присутствии катализатора [5]. Из этих двух методов, использование мочевины является наиболее используемой, экономичной и удобной технологией, так как он дает возможность получать более качественные продукты с наилучшим выходом продукции. Кроме того, эту технологию проще мультиплицировать с целью увеличения объемов изготовления с использованием стандартных аппаратов химической промышленности.
Есть два способа получения циануровой кислоты из мочевины. Одним из них — нагрев мочевины при высокой температуре (≥ 250 °С) без растворителя, а другой тримеризации мочевины в растворителе, с катализатором или без него [6-9]. Первый способ имеет следующий недостаток: при переходе продукта реакции из твердой фазы в жидкую фазу и обратно в твердую фазу, он может быть агглютинироваться или затвердевать и прилипать к нагретой поверхности аппарата или теплообменника, в результате чего качество продукта снижается и может быть повреждено оборудование [4]. Также, полученный продукт не может быть использован непосредственно без последующей очистки в химическом производстве. Если сравнить первый способ со вторым, то последний является экологически более чистым, безопасным и дешевым, полученная продукция может быть использована непосредственно, без очистки, но этот способ имеет одно слабое место: при высокой точке кипения растворитель необходимо регенерировать после использования несколько раз, и некоторые из используемых потенциально дорогих растворителей, таких как сульфолан, тетраэтиленгликоль диметиловый эфир, бутилкарбитол и циклогексанол могут быть потеряны.
В нашем исследовании, процедура для тримеризации мочевины в растворителе получила дальнейшее развитие (Схема 1).
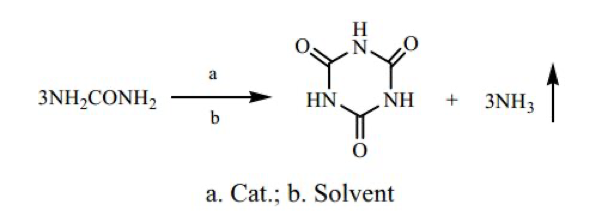
Мы попытались определить наиболее дешевый растворитель, такой как дизельное топливо или керосин для тримеризации мочевины и циануровая кислота была получена с использованием указанных растворителей имеющих высокую температурой кипения. В попытке улучшить выход продукции были проведены исследования влияний катализаторов на процесс при наших условиях эксперимента, мы получили результаты отличные от полученных Кавахара и Теджима [7], в их экспериментах циануровую кислоту получают путем нагревания мочевины в присутствии гидридов щелочных металлов, амидов щелочных металлов, а также солей щелочных металлов в органических растворителях. Например, мочевину обрабатывали NaH в тетраэтиленгликоле метилового эфира при 150 °С в течение 5 часов, что дало 99 % циануровой кислоты, тогда как без NaH было получено 0 % циануровой кислоты [7]. В нашем исследовании, выбранные нами катализаторы для реакции не улучшили намного выход продукции. Влияние температуры на результат также было тщательно изучено, и установленные оптимальные условия реакции были подтверждены в наших последующих широкомасштабных экспериментах.
Результаты и обсуждение
Учитывая, что тримеризации мочевины должно происходить при высокой температуре [11,12], при нагревании мочевины или биурета в инертном растворителе (сульфолан, 4-хлор-m-крезол, 3-метилсульфолан, эфир 2-метоксиэтила) и лучше при температуре выше 180 °C [11], наши первоначальные усилия были сосредоточены на растворителе, который будет использоваться. Первыми были испытаны три вида отдельных растворителей: керосин (растворитель со слабым запахом парафина, номер CAS64742-47-8, температура кипения ≈ (220-270) °С, дизель (светлое дизельное топливо, номер CAS 68334-30-5, температура кипения ≈ (250-400) °С, сульфолан, а также одна смесь растворителей — сульфолана и циклогексанола (табл. 1). Был получен хороший выход циануровой кислоты (88,7 % и 80,5 %, соответственно) при использовании керосина и дизеля при 180 °С (табл. 1).

Вероятно, наиболее благоприятным условием для формирования циануровой кислоты является использование растворителя более низкой полярностью, таким образом, использование неполярных растворителей типа керосина и дизеля лучше, чем полярных растворителей типа сульфолана и циклогексанола. Керосин и дизель также недороги и, вероятно, могут быть подвергнуты переработке.
Далее мы исследовали влияние температуры реакции (табл. 2).
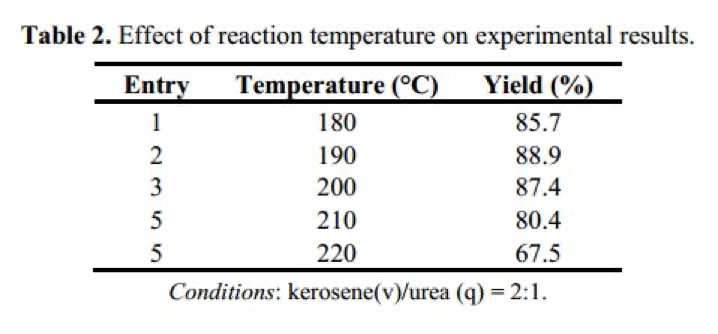
Результаты экспериментов показывают, что высокий выход продукта (88,9 %) получают при 190 °С. Температуры от 180 °С до 210 °С дают различные выходы циануровой кислоты, но реакция завершается быстрее при 210 °С. Процесс, казалось бы, может быть ускорен при более высоких температурах, однако выход продукции в данном случае не увеличивался. При температуре реакции выше 210 °C, мочевина может быть потеряна, хотя реакция проводилась под вакуумом и выход продукции уменьшался. Чтобы подтвердить данный факт холодная ловушка была помещена между реактором и насосом, и мочевина белого цвета была обнаружена в ловушке. Было обнаружено интересное явление: в начале процесса реакции из-за присутствия нерастворенных исходных материалов раствор был мутный, но к середине реакции смесь постепенно становилась прозрачной и к окончанию реакции снова мутной снова в результате появления нерастворимых веществ.
Наше исследование показало незначительное изменение выхода продукции в присутствии протестированных каталитических частиц (табл. 3).
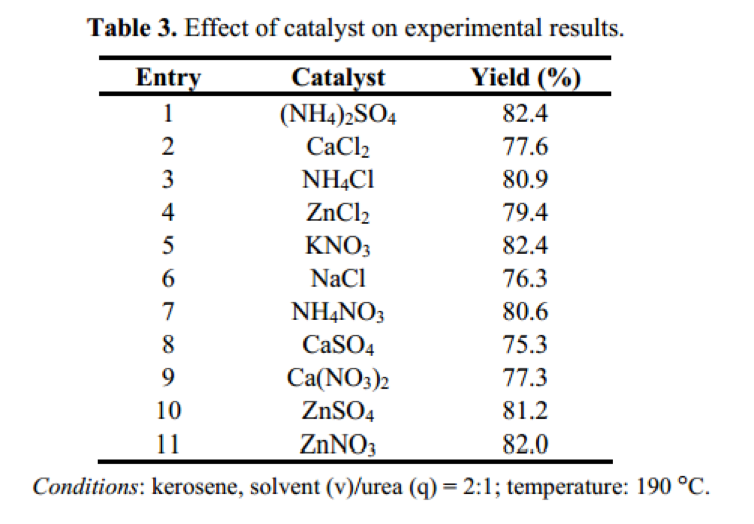
Наибольший выход (82,4 %) был получен в присутствии (NH4)2SO4. Различные катализаторы привели к маленькому изменению выхода продукции. Этот результат, как видно, имеет отличие от условий, когда мочевина нагревается напрямую без растворителя, в этом случае многие виды солей могут ускорять реакцию и увеличивать выход циануровой кислоты. В наших экспериментах, когда циануровую кислоту получают в органическом растворителе, катализатор не способствует увеличению выхода циануровой кислоты или ускорению скорости протекания реакции. Возможно, соли способствовали расплавлению системы при более низкой температуре и облегчали реакцию циклизации мочевины в твердом состоянии без растворителя. Возможно есть другие причины для незначительного влияния тестируемых катализаторов на выход циануровой кислоты, поэтому этот вопрос нуждается в дальнейшем изучении.
Эксперимент
Общее
Все химические вещества имели градацию «реактивы» и использовались в том виде как были приобретены. 1H-NMR (300 MHz) и 13C-NMR (75 MHz) спектры регистрировались на спектрометре Bruker AC-P300 с использованием CDCl3[1] в качестве растворителя; TMS[2] соответствовал внутреннему стандарту. ИК-спектры были определены на приборе FTS-185 с использованием тонких плёнок. Все реакции проводили в предварительно высушенной стеклянной посуде (150 °C, 4 ч) охлаждённой в потоке сухого воздуха.
[1] Дейтерированный хлороформ (примечание переводчика)
[2] Тетраметилсилан (примечание переводчика)
Синтез циануровой кислоты
Синтез циануровой кислоты показан на схеме 1. Мочевина (20 г) с (или без) катализатора была добавлена к растворителю (40 мл) находящемуся в круглодонной колбе. Смесь перемешивали при 150 °С, помещали в вакуум (10 мм рт. ст.) и затем нагревали при (160-220) °C. Реакцию контролировали с помощью индикаторной бумаги рН для тестирования эмиссии NH3. После того когда индикаторная бумага рН больше не изменяла цвет реакцию считали завершенной. Реакционную смесь охлаждали до 80 °С, помещали в воду (15 мл) и перемешивали в течение 1 часа для осаждения продукта. Полученный сухой твердый продукт нагревали до 150 °С в течение 2 часов, чтобы удалить кристаллизационную воду и получить чистую циануровую кислоту. Структура продукта была подтверждена температурой плавления, инфракрасным, 1H-NMR и 13C-NMR спектрами.
Выводы
Установлено, что жидкофазный синтез циануровой кислоты из мочевины со стабильно высоким выходом по удобной и дешевой технологии можно осуществлять с использованием керосина в качестве растворителя.
Благодарности
Это исследование во время его проведения было поддержано Национальной научной и технологической программой в период реализации Одиннадцатого пятилетнего плана (проект №2006BAF07B03).
Ссылки и примечания
1. Patil, S.P.; Padmanabhan, D. A facile preparation of (2,4,6-14C)-cyanuric acid under solvent-free conditions. J. Label Compd. Radiophar. 2002, 45, 539–542.
2. Zeng,Y.F. The application of cyanuric acid in chemical industry. Fine Chem. Ind. 1987, 2, 42–47.
3. Onoda, H.; Takenaka, A. Influence of addition of urea and its related compounds on formation of various neodymium and cerium phosphates. Mater. Chem. Phys. 2003, 82, 194–198.
4. Qiu, Y.; Gao L. Blue-emitting cyanuric acid–melamine complexes from urea thermolysis. Mater. Res. Bull. 2005, 40,794–799.
5. Gerd, F.; Janna, G.; Klapotke, Thomas M.K.; Burkhard, K. Synthesis, properties and dimerization study of isocyanic acid. Z. Naturforsch. B Chem. Sci. 2002, 57, 19–24.
6. Chun, H.; Min, S.S.; Methods and devices for preparing biuret and cyanuric acid. CN Pat. 10117296, 2008.
7. Shinichi, K.; Takahiro T. Preparation of isocyanuric acid from urea. JP Pat. 04364173, 2008.
8. Arakelyan, A.A.; Meliksetyan, A.A. Improvement of the production of cyanuric acid. Khim. Prom. 1988, 7, 442.
9. Jakub, D.; Lubomir, H. Method of manufacturing cyanuric acid. PL Pat. 166711, 1995.
10. Ohata, Y.; Aihara, M. Method for producing cyanuric acid. US Pat. 39, 53443, 1976.
11. Sidner, B. Preparation of cyanuric acid. US Pat. 35, 63987, 1971.
12. Jie, Y.; Gongying, W. Preparation of biuret in solvent. Fine Chem. Ind. 1987, 2, 42–47.
перевод © 2014 А. Н. Поляков